老人视力第一杀手:老年性黄斑变性!干细胞技术,助患者重见光明
 医学资讯
|
阅读量:次
医学资讯
|
阅读量:次
老年性黄斑变性(AMD,即年龄相关性黄斑变性)已取代白内障,成为60岁以上老人第一大致盲原因,而且是不可逆的!
“黄斑”是眼睛里长的黄色的老年斑吗?其实,黄斑是人视网膜的一部分,位于眼后极部,含有很多叶黄素,因而得名。它是人产生视觉看清东西的第一大功臣。
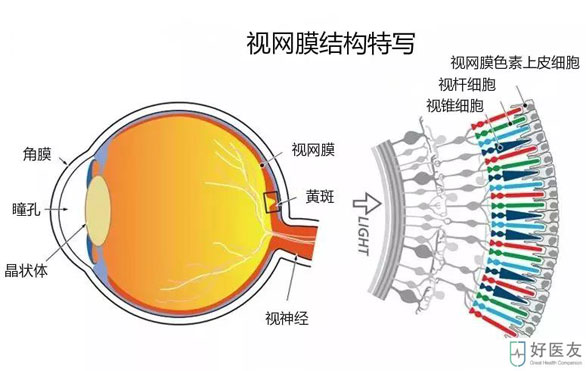
如果把眼睛比作照相机,黄斑相当于其中最重要的感光元件。
黄斑含有大量感光细胞,其对光作出反应并将电神经冲动传送到视神经,并进入大脑。在光感受器后面,是一层视网膜色素上皮细胞(RPE),它有很多功能:光吸收、供应营养、空间离子缓冲、视觉循环、吞噬作用、分泌和免疫调节等。AMD患者因RPE丧失,导致光感受器退化,从而丧失视力。
临床上,AMD分为干性和湿性。
其中,干性AMD已成为眼科重大临床挑战,也是进行性失明的主要原因之一。它通常起病缓慢,眼底特征性表现为黄斑区玻璃膜疣、色素紊乱及地图样萎缩。干性AMD患者阅读、驾驶能力都会受到影响,甚至无法辨别亲人的面孔,数百万人因其丧失了中央视力。
补充维生素虽可能减缓病情进展,但尚无有效治疗方法。
令人振奋的是,经过十多年的研发,南加州大学(USC)金斯伯格生物医学治疗研究所的团队,开创了一种治疗干性AMD的革命性新方法。
该疗法有望成为首个获FDA批准的干性AMD疗法,让数百万患者重见光明。
他们开发了一种由胚胎干细胞衍生的视网膜植入物及配套手术技术,帮助干性AMD患者恢复视力。
这项新技术及其1/2a期临床试验详情发表在美国眼科学会旗下《眼科学视网膜》杂志。
◎ 为突破手术“禁区”,他们从设计新工具开始

这项创新疗法由多个部分组成,从设计全新的视网膜植入物开始,每个环节都需要创新。
RPE丧失及其导致的功能障碍,是AMD进展的症结所在。
研究团队利用干细胞在实验室中培养RPE组织,并将其植入患者的眼睛,减缓或逆转视网膜损伤。
其实,也有其他团队也曾试过这样做,但难点在于如何使细胞均匀分布。
金斯伯格研究所团队研发了一种由聚对二甲苯制成的薄膜,细胞可在单层的薄膜上均匀生长。
下一个挑战在于,如何成功地将其植入眼睛中?
凯克医学院眼科副教授、玻璃体视网膜手术外科医生Amir Kashani博士指出,在实操中,要在仅1/4毫米厚的视网膜下植入RPE细胞层。通常,眼科医生不会在视网膜下进行手术,这里是手术“禁区”。移植干细胞的难度可想而知。
能在视网膜下腔进行手术的工具十分有限,大多数现有工具都是三四十年前设计的,相对笨重,通常用于移除疤痕组织或其他损伤,并不适合进行视网膜下腔间隙植入手术。
因此,研究团队决定从头开始,设计一种全新的工具。
新工具必须同时满足多个条件:必须由无毒材料制成;其设计必须易于复制,且必须足够小(毫米级),可在眼内进行微创手术,但又要足够大,以免压碎要递送的组织植入物。
研究团队研发了一种一次性镊子,它有一个内置隔间来封装植入物,还有一个滚轮来展开植入物。
植入物本身的形状像一个酒瓶,镊子抓住狭窄的一端,将植入物滚动到隔间中,使其弯曲折叠,然后外科医生最终可以将其放出来,平放在眼内。
◎ 人为制造“视网膜脱离”,只为争取手术空间
新工具和植入物都有了,一种全新的手术方法应用而生。
如何在黄斑组织AMD退化区域为植入物创造空间呢?研究者采用“气泡成形术”人为制造了一个“视网膜脱离”,从而在视网膜下留出了一小块空间。
“视网膜脱离通常是要治疗的,而我们反其道而行之。在这种特殊情况下,我们必须在瘢痕组织与周围环境非常粘连的区域内,制造可控的‘视网膜脱离’。”
Kashani博士说,“最大的挑战在于,如何在不损害视网膜的情况下将其分离。”
仅产生气泡还不够,他们还利用水压将一个细胞层与另一个细胞层分开,这一过程称为“靶向水剥离”。
为监控手术过程并避免并发症,部分患者使用光学相干断层摄影术(OCT)从细胞水平监控手术过程。
临床试验结果显示:这项新技术是可行的。
试验共纳入16名平均年龄78岁(69-85岁)的受试者,平均手术时间160分钟(121-466分钟)。
所有受试者中,平均86.9%的AMD退化区域被植入物成功覆盖(其中在5人达到90%)。未发现与植入物或手术相关的严重不良事件。
除了在术中使用OCT外,这项技术在早期AMD患者监测其地图样萎缩进展方面也很有应用前景。
OCT等诊断方法尚未被纳入早期AMD的标准筛查方案,但未来,这对AMD疾病分类和治疗可能至关重要。
目前,干细胞技术在AMD治疗方面已有了突破性进展,为因AMD失明的老人开启了重见光明的新希望!期待它能带给我们更多惊喜。
2020-07-27 16:54

好医友小编
联系医学顾问
医学顾问微信在线
