哮喘三联疗法获批,中国哮喘患者迎来创新药
 医学资讯
|
阅读量:次
医学资讯
|
阅读量:次
哮喘是一种常见慢性呼吸系统疾病。据统计,中国有超过4800万的哮喘患者,其中轻度哮喘患者占总人群的75%以上,且大部分都未被及时准确的诊断和治疗。哮喘如果不能得到及时控制,将给患者带来严重的健康负担和经济负担。目前,全球已有多种哮喘疗法获得批准,但是仍然有超过40%哮喘患者的症状得不到有效控制。
5月,中国国家药监局(NMPA)最新公示,诺华(Novartis)公司的茚达特罗/格隆溴铵/糠酸莫米松吸入粉雾剂已正式在中国获批。公开资料显示,这是一款名为Enerzair Breezhaler的每日一次固定剂量复方产品,由长效β2受体激动剂茚达特罗、长效毒蕈碱拮抗剂格隆溴铵,以及吸入皮质类固醇糠酸莫米松这三种有效成分构成,主要用于治疗症状不受控制的哮喘患者。
Enerzair Breezhaler(QVM149)是一种维持疗法,旨在帮助那些接受长效β2受体激动剂和吸入皮质类固醇后,症状仍然加剧的哮喘患者控制症状。此前,Enerzair Breezhaler已在日本、加拿大和欧盟等国家和地区获得批准上市。根据诺华公开资料,这款药物是其潜在重磅药物之一。
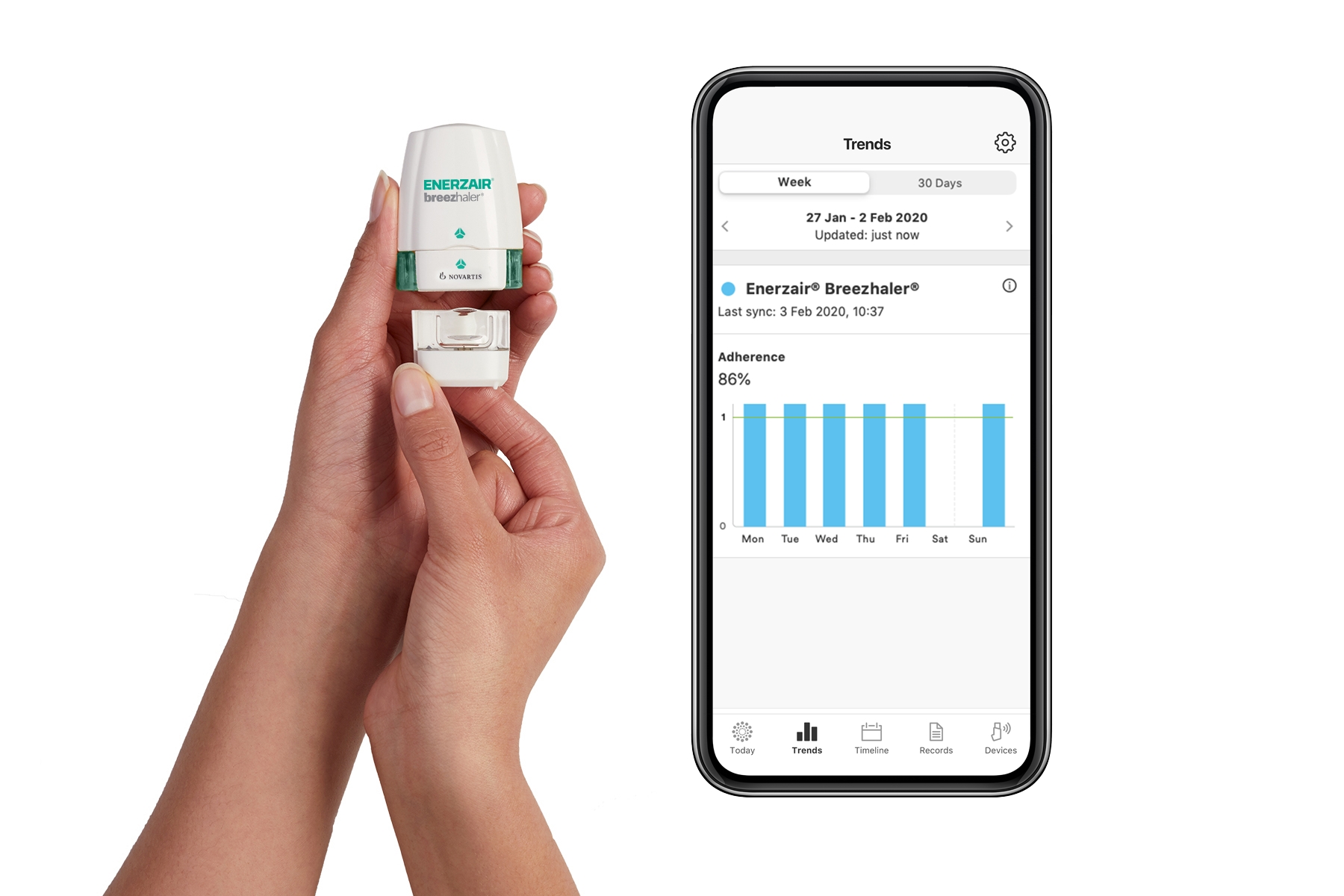
该药备受关注的一个原因在于其特殊的给药系统。据介绍,这一三联复方药物使用一种名为Breezhaler的给药系统,它能够让患者使用一个吸入器,就能够准确自我给药。伴随着数字软件和植入到Breezhaler中的传感器,这款疗法能够提供患者用药确认、服药提醒、以及让他们的医生们能够获得客观的治疗数据,帮助更好地做出治疗决定。
此前,Enerzair Breezhaler已经在一项名为IRIDIUM的随机、双盲、含活性对照的3期试验中获得积极结果。该研究纳入超过3000例哮喘患者,他们都曾接受过中/高稳定剂量的长效β2受体激动剂/皮质类固醇(LABA/ICS)的治疗,但症状仍未得到有效控制。试验结果显示,与活性对照组相比,候选药显著改善哮喘控制不佳成年患者的肺功能,并改善了患者的1秒用力呼气量(FEV1)。在第26周时,QVM149组在哮喘问卷评分(ACQ-7)方面显示了对哮喘控制的改善。
根据诺华早前发布的新闻稿,众多哮喘患者用药后症状无法控制,表明他们需要新的药物、给药方法、患者支持,以确保正确服药并达到治疗目标。每日一次的Enerzair Breezhaler结合一个数字软件,可以帮助医生和患者在疾病管理方面进行更好的协作,从而改善那些症状尚未得到控制的哮喘患者的生活质量。
这款创新的哮喘组合疗法在中国获批,希望该药的到来,能让更多哮喘患者获益。
2021年7月8日,安进(Amgen)和阿斯利康(AstraZeneca)联合宣布,美国FDA已受理了双方共同开发的抗胸腺基质淋巴细胞生成素(TSLP)单克隆抗体疗法tezepelumab的生物制品许可申请(BLA),用于治疗哮喘。FDA同时授予这一BLA优先审评资格,预计在2022年第一季度做出回复。

全球估计有3.39亿哮喘患者,大约10%患有重度哮喘。尽管使用了吸入性哮喘控制药物,许多重度哮喘患者的症状仍未得到控制。由于重度哮喘的复杂性,许多患者具有不明确或多种炎症驱动因素,可能不符合使用当前生物制品的条件或对其反应不佳。
Tezepelumab是一种潜在“first-in-class”药物,可阻断TSLP的作用。TSLP是一种上皮细胞因子,位于多个炎症级联反应的顶端,启动过敏性、嗜酸性粒细胞和其他类型与严重哮喘相关的气道炎症的过度免疫反应。美国FDA于2018年9月授予tezepelumab突破性疗法认定,用于治疗无嗜酸性粒细胞表型的重度哮喘患者。
此次BLA是基于名为PATHFINDER的临床开发项目,包括关键性3期临床试验NAVIGATOR的结果。NAVIGATOR试验结果于2021年5月发表在《新英格兰医学杂志》上。试验结果显示,在治疗症状未受控制的重度哮喘患者时,tezepelumab达到试验所有主要终点和关键性次要终点。与安慰剂相比,将每年哮喘急性加重率(AAER)降低56%(p<0.001)。
好医友表示,对于医生和数百万患者来说,严重哮喘是一种具有挑战性的复杂疾病,具有高度未满足的医疗需求,。Tezepelumab代表了广泛的重度哮喘患者群体的一种潜在的变革性治疗选择。
2021-07-21 09:01

好医友小编
联系医学顾问
医学顾问微信在线
