三个月打一针!这种活不过5年的罕见病,迎来新型疗法
 其它
|
阅读量:200次
其它
|
阅读量:200次
遗传性转甲状腺素淀粉样变性(hATTR)是一种可遗传的退行性致命性疾病,由TTR基因突变导致。
进行性神经病变和心肌病为该疾病主要特征。该病具有很高的死亡率,确诊后的中位生存期为4.7年,有心肌病特征患者生存期更低(3.4年)。
2018年,首款RNAi药物Patisiran(Onpattro)获FDA批准,成为首个治疗遗传性转甲状腺素蛋白淀粉样变性伴多发性神经病(hATTR-PN)患者的药物。Onpattro通过阻断TTR蛋白的生成来发挥作用,但需每3周静脉给药一次。
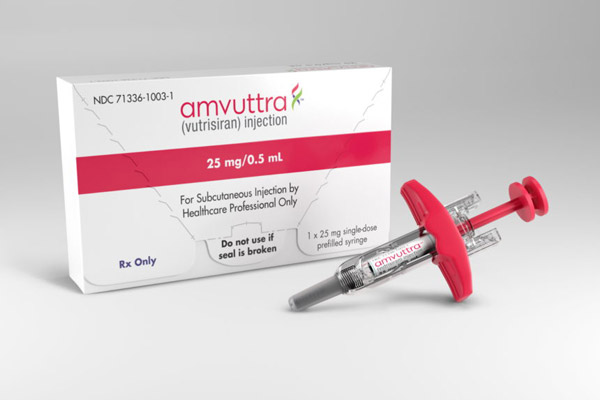
近日,美国FDA已批准Amvuttra(Vutrisiran)用于治疗hATTR-PN成人患者。

好医友获悉,Amvuttra每3个月皮下注射一次,是首款也是唯一一款可逆转神经病变损伤的疗法。
Amvuttra是一种双链小干扰RNA(siRNA),靶向突变型和野生型转甲状腺素蛋白(TTR)信使RNA(mRNA)。减少TTR淀粉样蛋白在组织中的沉积,促进组织中沉积的TTR淀粉样蛋白的清除,并恢复这些组织的功能。
FDA的批准是基于一项全球随机、开放标签III期研究的积极结果,该研究评估了Amvuttra在不同组hATTR-PN患者中的疗效和安全性。
164名患者以3:1的比例随机接受Amvuttra或Patisiran治疗,持续18个月。
结果显示,Amvuttra达到研究的主要终点。
◎Amvuttra组改良神经病变损害评分+7较基线平均降低(改善)2.2分,而安慰剂组平均升高(恶化)14.8分;
◎第9个月时,Amvuttra显著改善了多神经病变的症状和体征,50%的患者疾病表现停止或逆转;
◎Amvuttra在第18个月的疗效结果与第9个月的数据一致;
◎Amvuttra安全性和耐受性良好,未发生药物相关停药或死亡事件。
据了解,Amvuttra 25mg/0.5mL单剂量预装注射剂型预计将于2022年7月上市。
好医友指出,FDA此次的批准对hATTR患者来说非常鼓舞人心,他们亟需新的、更便利的疗法来治疗这种进行性、危机生命的疾病。Amvuttra有望成为新的标准疗法。
参考来源:
https://www.empr.com/home/news/amvuttra-approved-for-polyneuropathy-of-hereditary-transthyretin-mediated-amyloidosis/
2022-06-16 16:24

好医友小编
联系医学顾问
医学顾问微信在线
